Gebruiker:T.vanschaik/Kladblok1
| Waterstofdisulfide | ||||
|---|---|---|---|---|
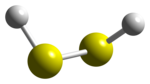
| Structuurformule en molecuulmodel | ||||

| ||||
Afstanden: H-S: 135 pm; S-S: 206 pm
| ||||
| ||||
■ Zwavel, S ■ Waterstof, H | ||||
| Algemeen | ||||
| Molecuulformule | ||||
| IUPAC-naam | Diwaterstofdisulfide | |||
| Andere namen | Disulfaan, Waterstofpersulfide, Thiosulfeenzuur | |||
| Molmassa | 66,14 g/mol | |||
| SMILES | SS
| |||
| InChI | 1/H2S2/c1-2/h1-2H
| |||
| CAS-nummer | 13465-07-1 | |||
| PubChem | 108196 | |||
| Beschrijving | Bleekgele vloeistof[1] | |||
| Fysische eigenschappen | ||||
| Dichtheid | 1,334 g/cm³[1] | |||
| Smeltpunt | −89,6 °C[1] | |||
| Kookpunt | 70,7 °C[1] | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Diwaterstofdisulfide is een anorganische verbinding met de formule . Deze waterstofverbinding uit de zuurstofgroep is een bleekgele, vluchtige vloeistof met een kamfer-achtige geur. De verbinding ontleedt makkelijk in waterstofsulfide en elementaire zwavel.[2]
Structuur[bewerken | brontekst bewerken]
De verbindingentussen de atomen in kan geschreven worden als . Daarmee is de structuur van het molecuul goed vergelijkbaar met die van waterstofperoxide. Beide moleculen zijn duidelijk niet vlak en hebben symmetrie C2. De tweevlakshoek tussen en is 90,6°. Dit is veel minder dan de 111,5° die voor gevonden wordt. De bindingshoek is 92°, heel dicht bij de 90° van ongehybridiseerde divalente zwavel.[2]
Synthese[bewerken | brontekst bewerken]
Diwaterstofdisulfide kan gesynthetiseerd worden door het kraken van polysulfanen volgens de vergelijking:
De voornaamste verontreiniging die hierbij ontstaat is trisulfaan . Het benodigde polysulfaan wordt gemaakt in de reactie van zoutzuur met een oplossing van een nattriumpolysulfide in water. Het polysulfaan scheidt zich als een olie (zwaarder dan water) af uit het reactiemedium.
Reacties[bewerken | brontekst bewerken]
Bij contact met water of alcoholen ontleed snel en onder milde condities tot waterstofsulfide en elementaire zwavel.
is zuurder dan , hoewel er geen waarde voor Kz of pKz genoemd worden in de literatuur.[2]
In de organische chemie addeert waterstofdisulfide aan alkenenwaarbij disulfides en thiolen ontstaan.[3]
Quantum tunneling en onderdrukking daarvan in deuteriumdisulfide[bewerken | brontekst bewerken]
In deuteriumdisulfide, , diwaterstofdisulfide waarin beide waterstofatomen zijn vervangen door deurerium, heeft een vergelijkbare geometrie als zelf. Kijkend langs de as van de zwavel-zwavelbinding maken bindingen naar de waterstof- of deuteriumatomen een hoek van ongeveer 90° met elkaar. Het achterste H- of D-atoom kan echter met de klok mee verdraaid zijn, of juist ertegenin. De verbinding vertoont chiraliteit. Hoewel de structuur dus een duidelijk chirale component heeft, treedt interconversie (tunneling) tussen de twee vormen zo makkelijk op, dat voor een geïsoleerd molecuul de wisseling tussen beide vormen met een periode van ongeveer 5,6 ms optreedt.[4]
The deuterated form of hydrogen disulfide, deuterium disulfide Sjabloon:Chem2 (dideuterodisulfane), has a similar geometry to Sjabloon:Chem2, but its tunneling time is slower, making it a convenient test case for the quantum Zeno effect, in which frequent observation of a quantum system suppresses its normal evolution. Trost and Hornberger[5] have calculated that while an isolated Sjabloon:Chem2 molecule would spontaneously oscillate between left and right chiral forms with a period of 5.6 milliseconds, the presence of a small amount of inert helium gas should stabilize the chiral states, the collisions of the helium atoms in effect "observing" the molecule's momentary chirality and so suppressing spontaneous evolution to the other chiral state.[6]
Health effects[bewerken | brontekst bewerken]
In high concentrations, it can cause dizziness, disorientation and ultimately unconsciousness.[7]
| Bronnen, noten en/of referenties
Dit artikel of een eerdere versie ervan is een (gedeeltelijke) vertaling van het artikel Hydrogen disulfide op de Engelstalige Wikipedia, dat onder de licentie Creative Commons Naamsvermelding/Gelijk delen valt. Zie de bewerkingsgeschiedenis aldaar. Historische literatuur
Verwijzingen in de tekst
|












