Lithiumacetaat
| Lithiumacetaat | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
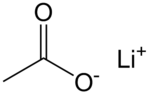
Structuurformule van lithiumacetaat
| ||||

| ||||
Lithiumacetaat-kristallen (dihydraat)
| ||||
| Algemeen | ||||
| Molecuulformule | C2H3LiO2 | |||
| IUPAC-naam | lithiumethanoaat | |||
| Molmassa | 65,98502 g/mol | |||
| SMILES | [Li+].CC(=O)[O-]
| |||
| InChI | 1S/C2H4O2.Li/c1-2(3)4;/h1H3,(H,3,4);/q;+1/p-1
| |||
| CAS-nummer | 546-89-4 | |||
| EG-nummer | 208-914-3 | |||
| PubChem | 3474584 | |||
| Wikidata | Q416969 | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H302 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P264-P270-P301+P312-P330-P501 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | vast | |||
| Kleur | wit | |||
| Dichtheid | 1,26 g/cm³ | |||
| Smeltpunt | 286 °C | |||
| Oplosbaarheid in water | 450 g/L | |||
| Goed oplosbaar in | water | |||
| Geometrie en kristalstructuur | ||||
| Kristalstructuur | (watervrij) triklien (dihydraat) orthorombisch | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Lithiumacetaat is het lithiumzout van azijnzuur, met als brutoformule CH3COOLi. De stof komt voor als witte kristallen, die zeer goed oplosbaar zijn in water. Lithiumacetaat vormt ook een dihydraat.
Synthese[bewerken | brontekst bewerken]
Lithiumacetaat kan bereid worden door reactie van lithiumhydroxide of lithiumcarbonaat met azijnzuur:[1]
Kristalstructuur[bewerken | brontekst bewerken]
Lithiumacetaat kristalliseert als dihydraat uit in een orthorombische kristalstructuur. Het behoort tot de ruimtegroep Cmm2 en de parameters van de eenheidscel bedragen:[2]
- a = 6,86 Å
- b = 11,49 Å
- c = 6,59 Å
De watervrije kristallen bezitten een trikliene structuur en behoren tot ruimtegroep P1. De parameters van de eenheidscel bedragen:[3]
- a = 9,29 Å
- b = 12,13 Å
- c = 6,76 Å
- α = 101° 0'
- β = 100° 19'
- γ = 105° 5'
Toepassingen[bewerken | brontekst bewerken]
Lithiumacetaat wordt in het laboratorium gebruikt als buffer bij de gel-elektroforese van DNA en RNA. Het bezit een lagere elektrische geleidbaarheid en bijgevolg is de warmteontwikkeling een stuk lager dan wanneer de klassieke TAE-buffer wordt gebruikt. Op die manier kan de aangelegde spanning verhoogd worden en kan de elektroforese versneld worden. Wanneer kleinere DNA-fragmenten dienen te worden gescheiden wordt echter gebruikgemaakt van een lithium- of natriumboraatbuffer, omwille van de hogere resolutie.
Verder wordt lithiumacetaat gebruikt als corrosie-inhibitor in polyfenylsulfideharsen en als katalysator bij de productie van polyesters, alkydharsen en acrylpolymeren.
Externe link[bewerken | brontekst bewerken]
Bronnen, noten en/of referenties
|



